1
序言
III期临床试验是新药临床研究阶段的关键性试验,是新药能否最终获批上市的临床基础。III期临床试验又称为确证性临床试验,其是为了进一步确证II期临床试验(探索性临床试验)所得到有关新药有效性和安全性的数据,为新药获得上市许可提供足够的证据。III期临床研究一般是关于更广泛人群、疾病的不同阶段,或合并用药的研究。另外,对于预计长期服用的药物,III期临床研究会进行药物延时暴露的试验。
2
III期临床试验全景
2.1 是什么(Who)
III期临床试验属于临床试验的治疗作用确证阶段,通过III期临床试验证明新药对目标适应症患者是安全有效的,其受益/风险比是可以接受的,为药物申报注册提供充分的依据,同时还为药品说明书和医生处方提供充分的数据。
2.2 为什么(Why)
II期临床试验受试者的样本量较少,其获得新药关于有效性和安全性的数据不足以支持新药获得上市批准。而III期临床试验可以通过足够多的受试样本量,进一步确证II期临床关于新药的疗效、长期安全性和受益/风险比,为新药最终获批上市提供确切的证据。
2.3 做什么(What)
III期临床主要用来回答一个问题:新药的受益/风险比如何?为回答该问题,III期临床试验一般是具有足够受试者样本量的随机盲法对照试验。III期临床试验也可以进行量-效关系的研究,同时也可以根据药物特点、目标患者的具体情况,进行药物相互作用等的研究。III期临床试验结束时需提供有统计学意义的结论,包括:新药目标适应症、所纳入的疾病人群、主要疗效指标、给药途径、用法用量及疗程、足够支持注册申请的安全性信息,并针对有效性安全性数据进行全面的风险/效益的评估等。另外,根据不同适应症或联合用药,申办者会将III期临床进一步细分为IIIa和IIIb期,申报者完成IIIa临床试验后即可申请上市批准,这样一般可以加快上市进度,提高市场收益;而通过IIIb临床试验可以进一步扩展新药适应症,加大市场收入。

2.4 怎么做(How)
试验原理:一般通过新药与现有标准治疗的比较,III期临床试验分为优效性试验和非劣效性试验。试验过程常采用随机盲法、阳性对照试验;无市售阳性药物时,可选用安慰剂进行对照。
受试者:目标适应症患者;
样本量:一般为数百至数千人;
接下来主要介绍常见的III期临床试验设计。
3
III期临床试验设计
Ⅲ期临床试验一般采用随机、平行对照试验设计,确证新药在特定目标人群中的有效性和安全性。在具体临床试验设计方案中,试验设计类型的选择至关重要,因为这决定了样本量的估计、研究过程及其质量控制。因此,研究者应根据试验目的和试验条件的不同,选择不同试验设计方案。
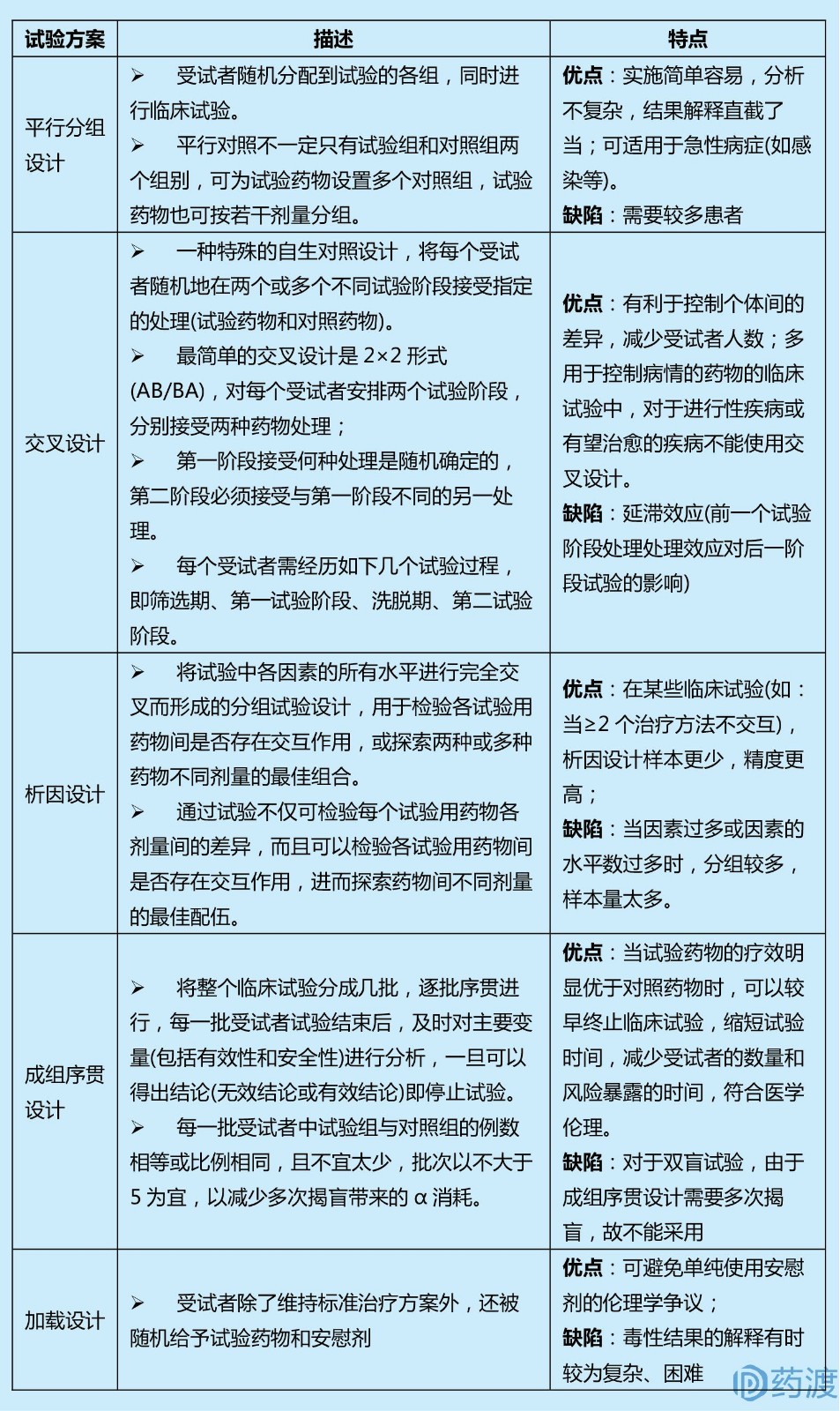
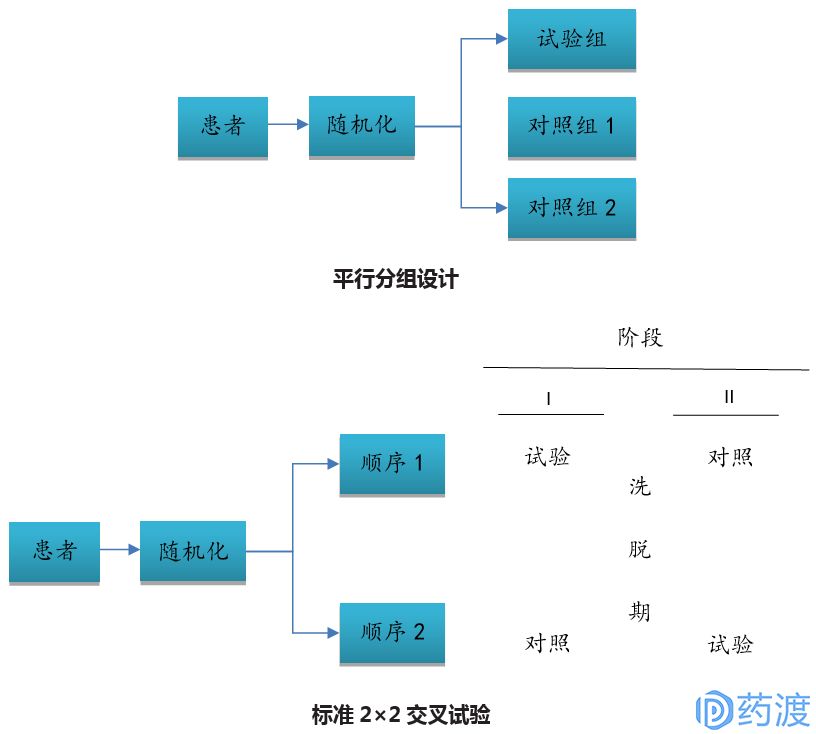
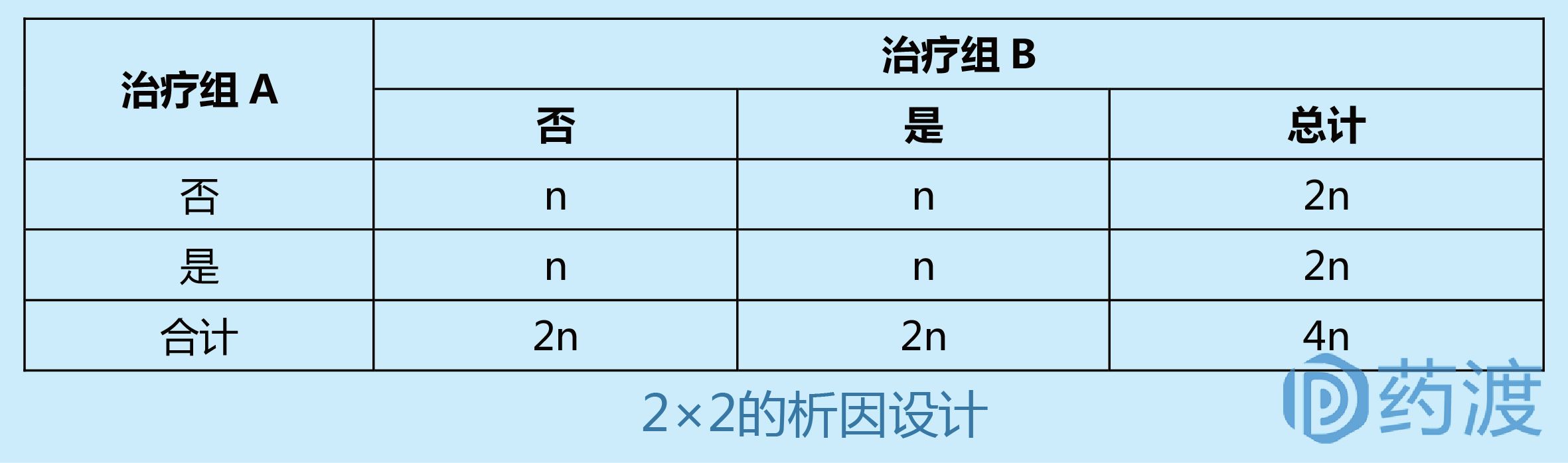
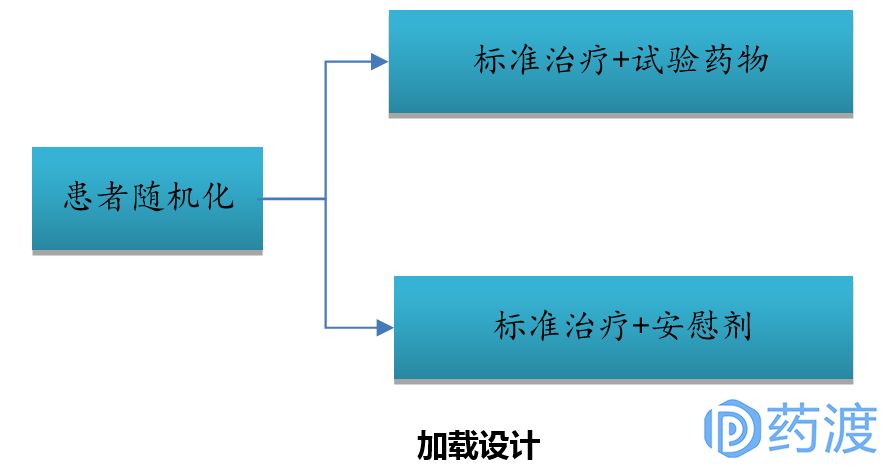
4
启示
一个新药经过首次数十人健康受试者的人体试验(First In Human,FIH),一直到5、6年后成千上百目标患者的III期临床试验,新药历尽磨难,可谓九死一生。整个过程历经人体耐受性试验、药代动力学试验、初步药效学试验、大规模确证性试验;其中可能还包括特定人群的考察(老人、儿童、功能缺陷等)、药物相互作用的考察等等。临床试验是新药是否批准上市的决定性阶段,任何一个环节出现问题,对于制药公司,尤其是初创公司打击是巨大甚至毁灭性的。同时,临床研究费用又是昂贵的,约占整个新药研发总费用的三分之二,高达数亿美金。正是由于临床研究的重要性和成本高昂,2007年FDA发布了《Target Product Profile — A Strategic Development Process Tool》,即基于目标产品特征(TPP)的产品开发策略。TPP是一种始于头脑的概念,即首先是申办者基于药物前期研究,通过设定未来产品的标签来定义新药开发目标,制定旨在支持产品标签(label)的具体临床试验;以TPP为主线和目标来全程、有效地指导和规划创新药临床开发和研究,提高申办者与管理当局在临床开发的各阶段(尤其是技术审评和会议)交流过程中效率,最终提升新药临床开发效率。
文中内容来源于网络,转载文章。